Crescimento de Cristais de Proteínas
A chave para o entendimento de
muitas funções biológicas passa pelo crescimento e posterior analise de
cristais de proteína. Milhões de dólares e de horas tem sido investidos para
produzir pequenos cristais que, se quase perfeitos em sua estrutura, podem
revelar informações importantes sobre a estrutura molecular das proteínas.
Deve-se ter em mente que os cristais em si pouco valem e, uma vez que os dados
sejam deles extraídos, podem ser descartados, pois é o conhecimento sobre as
macromoléculas de proteínas que é fundamental. Existem mais de 100.000
variedades de proteínas cujas funções vão do transporte do oxigênio e de
outros produtos químicos através do sangue, da formação de componentes de músculos
e de pele até, o mais importante para as pesquisas atuais, a luta contra doenças.
Alguns locais em certas proteínas, quando
modificados ou deformados, podem causar doenças ou outras funções indevidas,
do mesmo modo que organismos externos também podem afetar o funcionamento
correto de certos processos. Os cientistas muitas vezes conhecem a composição
química destas proteínas mas não conhecem sua estrutura que, para a mesma
composição química, implicam em comportamentos totalmente distintos de acordo
com esta estrutura espacial. A partir da visualização espacial é necessário
detectar qual o trecho da proteína que causa o mal. Entendendo e localizando
estes locais, pode-se projetar medicamentos que bloqueiem ou que tornem inativos
seus efeitos. O problema é que as proteínas são tão pequenas que não é
possível vê-las individualmente, quanto mais encontrar nelas locais específicos,
ou seja, é muito difícil determinar sua estrutura atômica. Para melhor enxergar estas peças chaves da regulagem do corpo humano,
os cientistas crescem cristais. Um cristal de proteína é um conjunto
tri-dimensional de moléculas no qual cada uma possuí a mesma orientação num
mesmo ambiente químico, mantendo o mesmo tipo de relação com suas vizinhas. O
efeito que existe ao se conseguir colocar todas estas moléculas nesse arranjo
é o da amplificação. Uma molécula solitária produz um sinal tão fraco que
é impossível de detectar; mas como todas as moléculas do cristal estão
fazendo exatamente a mesma coisa no mesmo exato instante de tempo, o sinal é
amplificado sendo então passível de detecção e, a partir dele, desvendar o
sinal de uma única molécula. Quanto mais ordenadas forem as moléculas do
cristal, melhor o nível de sinal e melhor a informação que poderá ser
passada aos projetistas de medicamentos.
A primeira observação sobre a cristalização de uma proteína foi feita por
F. L. Hünefeld em 1840 na Universidade de Leipzig na Alemanha, trabalhando com
hemoglobina. Logo em seguida outros grupos começaram a crescer cristais de
hemoglobina através da diluição de corpúsculos sanguíneos em água ou éter,
deixando a solução evaporar-se lentamente. Desde então, os cientistas não
pararam mais de crescer cristais de proteína com o único propósito de
purifica-las.
A partir de 1930 os pesquisadores entenderam a importância dos cristais como
fontes de informação sobre a estrutura das moléculas de proteínas e começaram
a utilizar a técnica de difração de raios-x. O feixe de raios-x incide sobre
o cristal que o espalha em pequenos pontos de luz que impressionam um filme, e a
figura de difração formada por estes pontos esta relacionada com a estrutura
da molécula. Os especialistas em difração de raios-x passaram os anos 60
investigando milhares de cristais de proteínas. Por volta de 1970, com o
aperfeiçoamento e digitalização das técnicas de difração, chegou-se à
conclusão de que os cristais existentes não mais atendiam a precisão de
medida agora alcançada. Eram necessários novos métodos para crescer cristais
com maior qualidade.
Um método de crescimento de
cristais que já era amplamente utilizado é aquele onde se coloca uma solução salina junto
com uma solução de proteína; quando as duas soluções entram em contato, o
sal começa a afetar o solvente da proteína, concentrando a solução da
proteína até que a mesma comece a se cristalizar. Os cristais resultantes
eram, no entanto, frágeis e pequenos.
Suspeitou-se que a causa para a produção de cristais de baixa qualidade era a
convecção constitucional que ocorre devido a diferença de densidades sob a ação
gravitacional (ver Convecção). A
convecção constitucional acontece quando as moléculas de proteínas se difundem da
solução se adicionando ordenadamente à rede do cristal que está sendo
crescido. A fração da solução que está mais próxima das bordas do cristal
fica então com uma concentração de proteína menor (região de depleção)
que a do resto da solução, e portando com menor densidade. Está solução
menos densa tende a subir, enquanto a solução mais densa tende a afundar sob a
influência da aceleração da gravidade, criando fluxos convectivos perto do
cristal. Estas correntes de convecção são deletérias pois podem alterar a
orientação e posição das moléculas de proteína quando elas estão se
adicionando à rede cristalina, causando desordem no cristal.
 |
Convecção constitucional
(ou
induzida por diferença de densidades) que ocorre quando uma molécula de
proteína vinda da solução próxima do cristal se incorpora à rede
cristalina. A camada de solução em torno do cristal (região ou zona de
depleção) fica com uma concentração menor, e portanto menos densa, de
proteína, forçando a camada a subir. O restante mais denso da solução
afunda devido a aceleração da gravidade g, criando fluxos que
dificultam a introdução ordenada de novas moléculas de proteína ao
cristal. |
Outro efeito adverso no
crescimento de cristais em ambiente gravitacional é a sedimentação. Pequenos
cristais se deslocam para o fundo de uma gota da solução quando adquirem uma
massa maior do que àquela suportada pela gota em suspensão. Quando isto
acontece, cristais parcialmente formados podem cair no topo um do outro formando
diferentes sítios de nucleação que continuarão a crescer individualmente, não permitindo o crescimento de
um único cristal (monocristal) de alta qualidade necessário aos estudos de difratometria.
O primeiro experimento em microgravidade, para testar a importância dos efeitos
de convecção na qualidade dos cristais de proteína, foi feita na Inglaterra a
bordo de um foguete de sondagem num vôo de apenas seis minutos. O vídeo do
experimento mostrou que o crescimento do cristal foi bem diferente dos
obtidos em gravidade terrestre, provando que a redução dos fluxos convectivos
permitiu a incorporação das moléculas através apenas de processos de
difusão. A seguir a NASA enviou no Space Shuttle, enzimas de beta-galactosidase
e proteínas de lisozima, para melhor estudar os fenômenos de cristalização
em microgravidade. Ambos os cristais crescidos no espaço se apresentaram
maiores e de melhor qualidade. Com a seqüência de vários experimentos
posteriores se comprovou a real vantagem do crescimento de proteínas na
ausência da gravidade.
 |
À direita, uma foto de
cristais de insulina crescidos em microgravidade que se apresentam maiores e mais bem estruturados
do que aqueles da mesma proteína crescidos na Terra (foto à esquerda),
que resulta em cristais menores e não tão bem ordenados. Com os cristais
de insulina crescidos no espaço é possível um estudo cristalográfico muito mais
apurado para determinação de sua forma e função, importantes para o
tratamento da diabetes. |
Várias questões foram então
abertas sobre o crescimento de cristais de proteína: como o fluxo do fluído
afeta o crescimento? Como a microgravidade poderia reduzir a nucleação, que na
Terra tende a acontecer muito rápida, e produzir muitos cristais de pequeno
tamanho em vez de apenas alguns poucos de grandes proporções? Quais novos
tipos de técnicas e equipamentos poderiam ser utilizados em microgravidade para
otimizar os resultados e aumentar o número de amostras transportadas?
Um equipamento disponível pela NASA desde de 1995, o Equipamento para
Cristalização de Proteínas em Microgravidade (PCAM), aumentou a capacidade de
transporte e facilitou carregamento de amostras para o vôo. Com ele foi
possível obter cristais de proteína muito maiores e mais perfeitos
possibilitando determinar, posteriormente, estruturas e sítios ativos
nunca antes visualizados.
As outras questões continuam sendo investigadas até hoje. O crescimento de uma
proteína se inicia com uma solução supersaturada, isto é, com uma quantidade
de moléculas de proteína maior do que aquela possível de se dissolver em um
dado solvente, o que torna o sistema termodinâmicamente instável. O problema
é então conhecer a solubilidade ideal de uma determinada proteína para que o
cristal cresça da melhor forma possível. Normalmente em laboratórios no solo,
isto pode ser determinado por tentativa e erro; é porém muito custoso, senão
impossível no espaço. Já existem, no entanto, métodos que determinam,
através da luz de um laser espalhada pela solução, qual diluição é mais
favorável à cristalização.
Uma vez determinada a melhor solução, geralmente é empregado um de dois
métodos para o crescimento de proteínas: difusão de vapor ou difusão
líquido/líquido. Ambos objetivam equilibrar a solução da proteína e a de um
precipitante. No PCAM o método utilizado é o de difusão de vapor, onde uma
gota da solução da proteína sofre uma certa evaporação, para torná-la mais
concentrada, criando um sítio de nucleação para a posterior formação do
cristal. Já a técnica de difusão líquido/líquido, emprega uma célula com
duas câmaras separadas, e consiste na difusão de uma solução salina, ou de
algum outro precipitante, de um dos compartimentos para o outro compartimento
onde se encontra a solução de proteína. Conforme a concentração de sal
aumenta, a água da solução de proteína é retirada, fazendo com que sua
concentração aumente e ela comece a se cristalizar.
|
Sistema utilizado para
crescimento de cristais de proteínas em microgravidade, por difusão de
vapor, fabricado pela Spacehab, Inc. Possuí cerca de mil células de
crescimento que são acondicionadas em uma gaveta (locker) no veículo
orbital, mantida em temperaturas controladas. Estes tipos de equipamentos,
costumam possuir perfis de evaporação e gradientes de temperatura
controlados. |
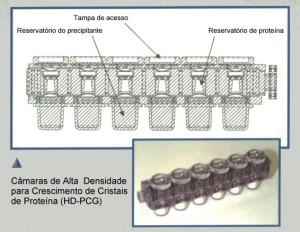
|
Quando o cristal cresce aparece uma competição entre a cinética de transporte
e a cinética de ligação das moléculas; conforme as moléculas se aproximam
da superfície do cristal, elas tem que se ligar fortemente ao mesmo para que se
obtenha um cristal de alta qualidade.
Este é um dos principais estudos feitos atualmente, tanto do ponto de vista
teórico como experimental, utilizando-se técnicas de difração de raios-x e
microscópios de força atômica. Questões como de que forma são feitas as
ligações de moléculas individuais na superfície do cristal, quais as forças
envolvidas, qual sua velocidade de crescimento, estão sendo respondidas com o
auxílio da microgravidade. O nível de supersaturação e a taxa de crescimento
afetam o arranjo cristalográfico e a quantidade de defeitos que ocorrem nos
cristais.
|

|

|
|
Foto de um cristal de
proteína obtida com um microscópio de força atômica (AFM), revelando
um defeito de deslocação do tipo hélice dupla em sua superfície. |
Difração de raios-x de
um cristal de proteína com estrutura bem ordenada, criando um padrão de
pontos bem definidos no filme, permitindo que um modelo da molécula de
proteína seja gerado por computador. |
O raio-x interage com a nuvem de
elétrons que forma a estrutura externa de cada átomo da molécula de
proteína. Num cristal imperfeito o aspecto dos pontos de difração é difuso.
Uma figura de difração de raios-x bem definida como a mostrada acima, permite
a construção de um mapa da densidade de elétrons, através do qual é
possível determinar a estrutura espacial da proteína e gerar modelos por computador.
Estes modelos permitem o entendimento do funcionamento da proteína e também a
determinação de sítios e áreas receptoras ativas, que controlam sua função
e ação no desenrolar de, por exemplo, uma doença. A partir deste conhecimento
a pesquisa farmacêutica pode projetar moléculas que se encaixem nos sítios
ativos da proteína, bloqueando sua ação, sem afetar o resto do corpo.
Exemplos de modelos de proteínas que estão sendo investigados para o projeto
de drogas farmacêuticas são a insulina e o estafilococo tipo A, um dos
principais causadores de infecção hospitalar. Atualmente cerca de 185
diferentes tipos de proteínas, RNA, DNA e vírus são pesquisados apenas no
programa de microgravidade da NASA. Com o início da operação da Estação
Espacial Internacional, prevê-se uma atividade ainda muito maior neste setor.
Cristais que crescem devagar em microgravidade, terão agora um tempo muito
maior para se desenvolverem completamente, com a vantagem de não passarem pelos
freqüentes distúrbios de aceleração (g-jitters) que ocorrem no Space Shuttle.
Ficará também mais viável o acompanhamento dos resultados, podendo repetir-se
várias vezes os experimentos com os ajustes necessários para se obter cristais
melhores e maiores para que se possa utilizar, inclusive, técnicas de
difração de neutrons que, interagindo diretamente com o núcleo dos átomos ao
contrário da difração de raios-x, que interage com suas nuvens eletrônicas,
poderá evidenciar com maior precisão os sítios ativos das
proteínas.
Também novas facilidades estão sendo planejadas para a ISS: espera-se ter a
bordo, entre outros equipamentos, microscópios de força atômica e até um
laboratório completo de crescimento de proteínas com gerador de raios-x de
baixa potência para analise in situ dos cristais de proteína crescidos em
microgravidade. Desta
forma não seria mais necessário trazer os cristais de proteína para a Terra
com todos os riscos do transporte e do tempo de espera de retorno, podendo serem
analisados diretamente no espaço e suas imagens transmitidas para a Terra.




